Preguntas frecuentes en
Bioquímica. (Bajar este documento en formato pdf)
1. ¿El
“efecto hidrofóbico” es lo mismo que la “interacción hidrofóbica”?
Si bien muchas veces se toman como sinónimos, algunos autores prefieren el uso de efecto más que el de interacción. Esto es debido a que no existe en este proceso una interacción atractiva entre átomos como por ejemplo la que existe entre dos partículas cargadas que se describe por la ley de Coulomb. En el “efecto hidrofóbico” los átomos o moléculas no se atraen por una interacción o “fuerza hidrofóbica” . La configuración final que adopta el sistema se debe a un cambio favorable de entropía, principalmente debido al solvente.
Ref. Biofísica. Volkeshtein.
Editorial Mir.
2. ¿Por
qué el efecto hidrofóbico aumenta con el aumento de la temperatura?
Desde el punto de vista termodinámico el efecto hidrofóbico está caracterizado por el DG del proceso (Atención!, en la bibliografía específica el DG del efecto hidrofóbico se mide como el DG del proceso de transferir un mol de una sustancia hidrofóbica, por ejemplo un alcano, una gas noble, etc, a agua. El sentido de este proceso es el inverso al que generalmente se usa en biología, por ejemplo, para explicar el plegamiento de una proteína).
Para explicar el efecto de la temperatura sobre el efecto hidrofóbico, recordemos que
DG= DH -TDS
Derivando esta ecuación con respecto a T tenemos:
![]() sabiendo que
las derivadas de la entalpía y la entropía son iguales a
sabiendo que
las derivadas de la entalpía y la entropía son iguales a
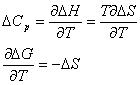 concluímos que
concluímos que
Esto quiere decir que siempre que tengamos un DS positivo (como el que ocurre en el efecto hidrofóbico) la variación del DG con la temperatura será negativa, de esta forma favoreciendo el proceso.
De donde sale este DS>0? En el caso de los sistemas con sustancias no-polares disueltas en agua, sabemos que el agua pierde “movilidad” en las proximidades inmediatas de las sustancias no-polares. Estas moléculas de agua no se comportan como el resto de las moléculas de agua que están alejadas de las superficies no-polares. En este tipo de sistemas es característico encontrar un Cp muy elevado dado justamente por la presencia de este tipo de “hidratación” (ver por ejemplo “Las moléculas hidrofóbicas en una disolución acuosa” pag 43, Bioquímica 3 ed. Mathews, Van Holde). Cuando las sustancias no-polares se “ocultan” esto es disminuye la superficie expuesta al agua, por ejemplo en el plegado de una proteína, las moléculas de agua que estaban formando parte de la capa de hidratación, recuperan su movilidad con un consiguiente aumento de entropía.
El efecto descripto ocurre cuando las temperaturas son relativamente bajas (por ejemplo menos de 80-90 grados). Al ir aumentando la temperatura, la diferencia de movilidad entre las moléculas que forman la capa de hidratación y las moléculas alejadas de esta capa, es prácticamente nula. De esta forma existe una temperatura en la que el DS se hace 0 y a estas temperaturas se dice que el efecto hidrofóbico está dominado por el DH.
Ref:
Proteins. Structures and molecular properties. 2nd Edition. Thomas
Creighton.
Hydrophobic effect in protein folding and other noncovalent processes involving proteins. Spolar, R, Ha, J and Record, T. PNAS. Vol 86:8382-8385. 1989.
3. ¿Cómo
calculo la carga neta de una molécula a un determinado pH?
Para resolver esta pregunta usemos el AcH. Supongamos que tenemos 25 ml de una solución acuosa 0.1M, A esta solución se le van agregando volúmenes de una solución 0.1M de NaOH.
Supongamos además que queremos calcular la carga neta a los siguientes pH=0, pH=4.7, pH=9.
En todo momento el pH de la solución va a estar dada por la ecuación de Henderson-Hasselbalch(HH).
![]()
sabiendo que el AcH se disocia en agua para dar
![]()
AcH Ac-
+ H+
El ácido será el AcH y la base Ac- si adoptamos la convención de Brownsted-Lowry. Así escribimos:
![]()
también sabemos que la carga neta de una molécula de AcH tiene carga neta igual a cero y que una molécula de Ac- tiene carga neta igual a –1. Cómo a cualquier pH siempre va a existir un equilibrio entre las formas ácida y básica, nos podemos preguntar cuál es la carga total neta a un determinado pH. Para esto usamos la siguiente ecuación:
![]()
donde i indica el número de especies químicas que puede formar la molécula, qi la carga neta formal de esa especie química y xi su fracción molar (o porcentaje de ocurrencia). En el caso del AcH, tenemos el Ac- y el AcH.
Calculemos la concentración de AcH en la solución a pH=0. Para esto tengamos en cuenta el balance de masa para el acetato. Así
0.1= [AcH]+[Ac-]
Podemos encontrar que la relación [Ac-]/AcH] usando la ecuación HH, esto da = 1.8 10-5
Que reeplazando en la ecuación anterior nos da
[AcH]=0.0999982
[Ac-]= 1.8 10-6
Calculando las fracciones molares tenemos= x(AcH)=0.999982 y x/Ac-)=1.810-5. Reemplazando en la fórmula calculamos la carga neta:
Carga neta a pH=0
= ![]()
Esto quiere decir que a pH=0 la especie predominante es el AcH, que como tiene carga neta =0, la carga total es parecida a 0.
Para pH=4.7 (4.7 es igual al pk del ácido acético) tenemos
De la ecuación de HH sacamos que Ac-/AcH = 1,
esto es ambas especies químicas se encuentran en la misma proporción, de aquí
que sus fracciones molares sean iguales a 0.5.
Entonces la carga neta a pH=4.7 = ![]()
Para pH=9, encontramos usando HH que Ac-/AcH = 18000. Otra vez usando el balance de masa tenemos:
0.1=[AcH]+18000 [AcH]
[AcH]= 5.55 10-6
[Ac-]= 0.0999
Calculando las fracciones molares y sustituyendo tenemos que
la carga neta será: ![]()
Así tenemos que a un pH muy bajo, la carga de la solución es prácticamente 0. Por el contrario la carga a pH=9 es negativa y corresponde mayormente a la especie predominante (Ac
Es muy importante darse cuenta que estas cargas netas están calculadas en base a un mol de AcH. Para comprobar esto noten que si titulamos 1mol de AcH, más halla del punto de equivalencia la especie predominante será el Ac-. Si tenemos un mol de AcH, la carga neta en esta situación será aproximadamente –1.
Ref. Problemas de Química. M
Sienko. Ed. Reverte.
4. Calcule el volumen de una solución de NaOH 0.1M necesarios para llevar 25 ml de una solución acuosa de AcH 0.1M a pH=0 a los siguientes pH=4.7, 9.
Este problema esta estrechamente relacionado con el anterior y pone de manifiesto una de las aplicaciones de la carga neta de una solución a un determinado pH.
Vimos antes que esta solución a pH=0 tiene carga neta –1.8 10-5. Si queremos llevar esta solución a un pH = 4.7, sabemos que la solución a este pH tiene carga neta = -0.5. ¿Cómo puedo usar las cargas netas para calcular el volumen de NaOH necesario para producir un determinado cambio de pH?
Uds. saben que las reacciones de neutralización ocurren equivalente a equivalente (esto es el agregado de un equivalente de NaOH (o una molécula de NaOH) a una solución de AcH, me va a generar una molécula de Ac-.
Podemos decir entonces que la diferencia de cargas neta entre el pH=0 y pH=4.7 me dará el número de equivalentes que tengo que agregar de NaOH. Así,
Dcarga neta = (carga neta a pH=9) – (carga neta a pH=0)= -1.810-5 + 0.5 = 0.4999982
El valor absoluto de esta diferencia es el número de equivalentes por mol que debo agregar para producir la variación de pH deseada. La cuestión es que nosotros no tenemos 1 mol de AcH sino que tenemos 25 ml de una solución 0.1M. Entonces nuestra concentración de AcH es 2.510-3 moles
Así, si para 1mol de AcH 0.49999 equivalentes de NaOH
![]()
![]()
Para 2.5 10-3
moles de AcH
x= 1.2499 10-3 equivalentes de NaOH
![]()
Si la solución de NaOH es 0.1M (= 0.1 N) tenemos que 0.1 equivalente 1000ml
3.1210-3 equivalentes x= 12.45 ml.
Este cálculo es muy importante. Debemos notar que si conocemos el volumen de NaOH empleado entre dos pH dados, sabiendo la diferencia de cargas que se puede calcular en forma teórica como vimos, uno podría estimar la concentración de una determinada sustancia (en el caso del ejemplo el AcH). Este tipo de cálculo se usa en varios problemas del seminario 2 y el TP de titulación de aminoácidos.
4. ¿Cómo
determino el PI de un polipéptido?
Supongamos que queremos determinar el PI del péptido Gly-His-Ile-Asp-Arg-Lys. Lo primero que tenemos que hacer es escribir la fórmula desarrollada del oligopéptido y encontrar cuales son los grupos funcionales que tienen comportamiento ácido-base.
6 5 4 3 2
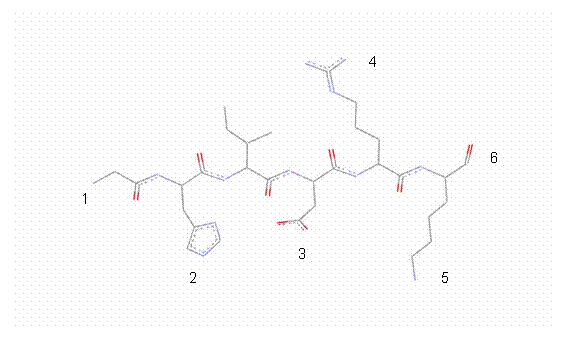

En este oligopéptido tenemos:
- Alfa amino de la Gly, pk= 9.58
- Imidazol de la His, pk= 6.04
- Beta carboxílo del Asp, pk= 3.71
- Guanidinio de la Arg, pk= 12.10
- Epsilo Amino de la Lys, pk= 10.67
- Carboxilo terminal de la Lys, pk= 2.9
Una vez identificados estos grupos debemos escribir todas las formas iónicas del oligopéptido. De esta forma tenemos:
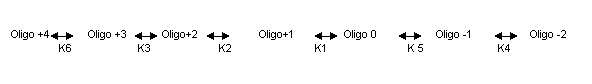
El PI de este oligopéptido estará entre K1 y K5, ya que es entre estos pK donde encontramos la forma neutra del oligopéptido.
La forma más aproximada de encontrar el PI es considerar que sólo las especies Oligo+1, Oligo 0 y Oligo –1 son importantes en cuanto a determinar la concentración de Oligo 0. Así sólo tendremos dos ecuaciones de Henderson-Hasselbalch (para pK1 y pK5). Usando estas dos ecuaciones tenemos que
PI= (pK1 + pK5)/2= 10.25
La resolución exacta del problema consistiría en resolver las 6 ecuaciones de Henderson-Hasselbalch, más la del balance de masa y el balance de carga (en este caso 8 ecuaciones con 8 incógnitas). Sabemos que cuando el pH=pI la suma de las cargas positivas con las negativas debe ser igual a cero. La resolución de este sistema da
PI = 10.1872
Vemos que la aproximación en este caso no es tan mala debido a que las especies Oligo+4, Oligo +3, Oligo +2 y Oligo +1 son despreciables a un pH=pI.
Una forma alternativa de resolver el sistema de las 8 ecuaciones es expresar la fracción de cargas positivas y negativas por la siguiente fórmulas:
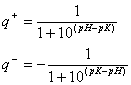
si pH=pI se debe cumplir que ![]() . De esta ecuación podemos sacar el PI del oligopeptido.
(Esta ecuación se puede resolver por ejemplo usando el Matemática)
. De esta ecuación podemos sacar el PI del oligopeptido.
(Esta ecuación se puede resolver por ejemplo usando el Matemática)
Ref. A
graphical approach to determine the isoelectric point and charge of small
peptides from pH 0 to 14. G D’Andrea and G Di Nicolantonio. J.C.E. 79:972-975. 2002.
Cálculos de Bioquímica. Irwin Segel 2
Ed. Editorial Acribia.
Polypeptide
amino acid composition and isolectric point. Comparison between experiment and
theory. Costas S. Patrickios and Edna Yamasaki. Analytical Biochemistry 231:82-91. 1995
5. ¿Por
qué varían los pK de los aminoácidos?
Si tomamos los valores de pK de los aminoácidos del problema anterior de distintas fuentes encontramos:
|
Grupo |
Bioquímica.
Mathews 3 Ed |
Biochemistry. Zubay 3 Ed |
J. Chem. Educ 79, 2002 |
|
Alfa amino de la Gly |
9.6 |
9.78 |
9.58 |
|
Imidazol de la His |
6.0 |
6.04 |
6.04 |
|
Beta carboxílo del Asp |
3.9 |
3.90 |
3.71 |
|
Guanidinio de la Arg |
12.5 |
12.48 |
12.10 |
|
Epsilo Amino de la Lys |
10.0 |
10.79 |
10.67 |
|
Carboxilo terminal de la Lys |
2.2 |
2.16 |
2.9 |
Como se puede observar vemos ligeras variaciones. Si calculamos el PI usando la ecuación del problema anterior obtenemos valores muy distintos: 9.79, 10.27 y 10.18 respectivamente para los valores de la tabla.
Recordemos que el pK es el –log(Ka), esto es el logaritmo de una constante de equilibrio. ¿De qué depende la constante de equilibrio? Si recordamos que :
DG° = -RT ln(Keq) vemos que Keq tiene las mismas variables que el DG°. En el caso de una constante de equilibrio en una solución, la constante de equilibrio dependerá de la temperatura, de la presión, y de características fisicoquímicas del solvente. En principio debemos esperar que estas variaciones son propias de cualquier determinación experimental.
Sin embargo, existen modificaciones del pK mucho más importantes desde el punto de vista cuantitativo. Estas variaciones se deben a modificaciones en las propiedades del solvente o a la modificación del entorno fisicoquímico de un amino ácido. Una de estas propiedades fisicoquímicas es la constante dieléctrica del solvente. Por ejemplo sabemos que la constante de disociación del ácido acético en agua es 1.8 10-5, dando un pK=4.76. También sabemos que el AcH se disocia dando un protón y un Ac-. Cómo la constante dieléctrica mide la capacidad del solvente de estabilizar cargas, esperamos que si modificamos la constante dieléctrica seguramente la Keq del ácido se modificará. Así podemos modificar la constante del medio (por ejemplo agregando cantidades crecientes de dioxano, que baja la constante dielectrica de la mezcla) veremos que el ácido acético se hace un ácido mucho más débil al disminuir la constante dieléctrica del medio como se ve en la siguiente figura:
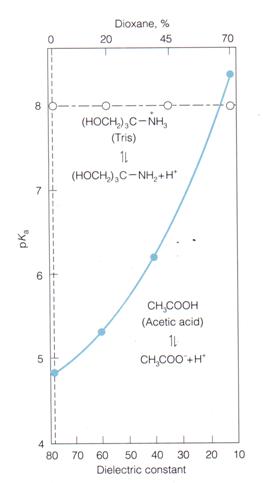
De la misma forma se ven modificados los pK de los amino ácidos cuando la constante dieléctrica varía, por ejemplo para un amino ácido en la superficie de la proteína (en contacto con el agua y constante dieléctrica parecida a 80) o uno en el interior de la proteína (constante dieléctrica entre 10-40 veces más chica que en el agua). En este ultimo caso los pK de un amino ácido pueden modificarse aumentando ya sea la acidez o la basicidad de los mismos dependiendo del entorno fisicoquímico. Pensemos, por ejemplo que este entorno fisicoquímico puede estabilizar a un anión (por ejemplo por la presencia de cargas parciales positivas) o lo puede desestabilizar completamente(por ejemplo un medio hidrofóbico).
Los gráficos que se muestran a continuación representan la variación de la carga de un determinado tipo de amino ácido en función del pH. Por ejemplo para el amino ácido His, se tomaron todas las His de una proteína dada y se le calculó la variación de la carga en función del pH.
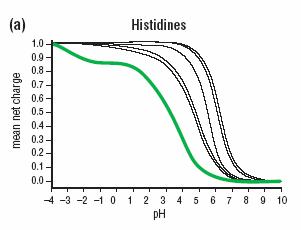
Es posible ver en el gráfico que no todas las His tienen el mismo pk aunque la mayoría tiene un pk de 6.5 en promedio. Sin embargo, existe una His que se aleja mucho del promedio (indicada con verde) Esta His está involucrada en ciertas reacciones enzimáticas y evolutivamente se ha creado un ambiente fisicoquímico para que esta His tenga un pK muy bajo.
Otro ejemplo lo podemos ver para los Glu de la misma enzima:
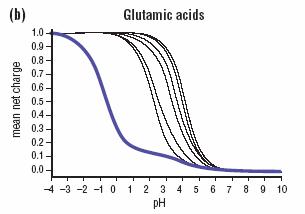
El Glu en línea azul posee un valor de pK exageradamente bajo (Qué entorno fisicoquímico esperarían encontrar para este Glu?)
Algunos autores han encontrado que los amino ácidos con pK anómalos están estrechamente ligados a la función biológica que sostiene la proteína.
Ref. Biochemistry. Mathews-Van Holde.
2 Edición
Ondrechen, M.J. et al.:
THEMATICS: a simple computational predictor of enzyme function from structure. Proc.Natl Acad. Sci. USA 2001,
98:12473–12478.
6.
¿Dos polipéptidos
que tengan el mismo pI tienen la misma carga a un determinado pH?
No necesariamente. Podemos encontrar polipéptidos que tengan exactamente el mismo pI, pero debido a la composición de amino ácidos que contengan a un determinado pH pueden tener cargas muy distintas. Por ejemplo consideremos a un péptido que contenga los siguientes grupos con comportamiento ácido/base:
Grupo alfa carboxilo terminal = pK = 2.5
Grupo beta carboxilo = 3.5
Grupo amino terminal = 8
Para este péptido podemos calcular el pI utilizando la ecuación que usamos en la pregunta 4, así
En el pI se cumplirá:
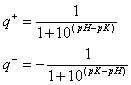
![]()
Esta ecuación se puede resolver usando el Matemática (ver como). Utilizando los pK arriba mencionados encontramos un pI = 2.999. A pH = 6, este péptido tendrá una carga neta igual a -0.9999.
Supongamos que ahora tenemos un péptido con una composición tal que tenga 2 residuos con un pK = 2.5, dos con un pK = 3.5 y dos con un pK = 8. Sabemos que los valores de los pK de los amino ácidos varían apreciablemente con sul entorno fisicoquímico, así que podríamos esperar encontrar esta composición en algún péptido. Por ejemplo un beta carboxilo debido a su entorno podría aumentar su acidez hasta llegar a un pK = 2.5 (de igual acidez que un grupo alfa carboxilo terminal). Si calculamos el pI de este nuevo péptido encontramos que tiene idéntico valor que el calculado anteriormente (pI = 2.999). Pero si ahora calculamos su carga neta a pH = 6 encontramos que tiene una carga neta = -1.9999, esto es el doble que en el caso anterior.
Si bien el pI de una molécula predice el valor de la carga que tendrá un polipéptido a un determinado pH (a un pH mayor que su pI, la carga será negativa y a un pH menor que su pI será positiva) esto no me dice la cantidad de carga.
Este tipo de problemas debe ser tenido en cuenta cuando uno quiere separa moléculas en base a sus cargas (por ejemplo utilizando una cromatografía de intercambio iónico o una electroforesis).